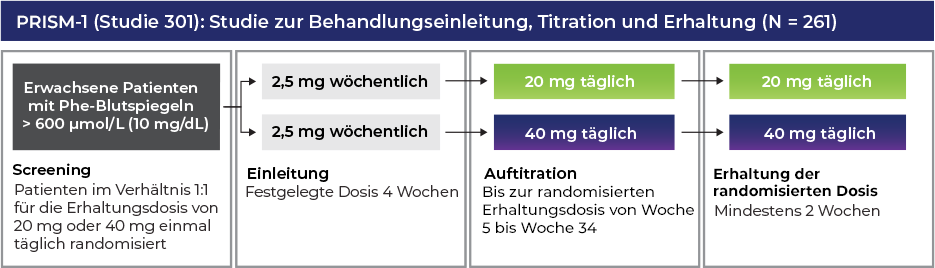
PALYNZIQ® wurde bei mehr als 350 Patienten* mit PKU in 7 Studien eingehend untersucht. Die umfangreichste Studie im klinischen Studienprogramm ist PRISM.1
Phase-3-Programm: PRISM-1- und PRISM-2-Studie1-3
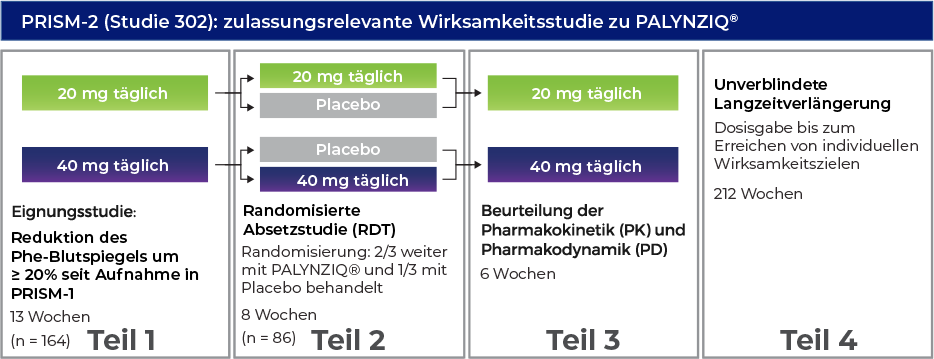

Randomisierte Absetzstudie (RDT)
- Die zulassungsrelevante Wirksamkeitsstudie wurde über eine RDT durchgeführt, eine 8-wöchige, doppelblinde, placebokontrollierte Studie, in der Patienten nach Randomisierung im Verhältnis 2:1 entweder ihre randomisiert zugewiesene Behandlung mit PALYNZIQ® (
20 mg oder40 mg einmal täglich) fortführten oder ein passendes Placebo erhielten4 - Der Eintritt in die RDT war davon abhängig, ob die Patienten nach einer bis zu 13-wöchigen Phase der zusätzlichen Behandlung mit PALYNZIQ® einen Rückgang des Phe-Blutspiegels um ≥ 20% gegenüber dem Ausgangswert vor der Behandlung erreichten4
- Von den 164 in die Studie
PRISM-2 aufgenommenen Patienten erreichten 86 (52%) dieses Ziel und traten in die RDT ein4
- Von den 164 in die Studie
Primärer Endpunkt: Veränderung des Phe-Blutspiegels von Beginn (Baseline) der randomisierten Absetzstudie bis Woche 8 bei Patienten, die randomisiert mit PALYNZIQ® behandelt wurden, im Vergleich zu Patienten, die Placebo erhielten4
Sekundäre Endpunkte: Anhand der Messinstrumente ADHD
Ausgangsmerkmale der Patienten1
- Die Mehrzahl der Patienten hielt vor und während der Studie keine Phe-reduzierte Diät ein*
Demographische Daten und Ausgangsmerkmale der nicht vorbehandelten Patienten (ITT-Population; N = 261)1
ITT: Intent-To-Treat.
*Eine Phe-reduzierte Diät ist dahingehend definiert, dass > 75% des Proteins über medizinische Nahrungsmittel aufgenommen werden.4
†Die von der European Food Safety Authority (EFSA) empfohlene Gesamtproteinaufnahme aus natürlichen Nahrungsmitteln beträgt für Erwachsene
Literatur: 1. Thomas J et al. Mol Genet Metab 2018;124(1):27–38. 2. Thomas J et al. Mol Genet Metab 2018;124(1):27–38 [supplementary material]. 3. PALYNZIQ® Fachinformation. 4. Harding CO et al. Mol Genet Metab 2018;124(1):20–26. 5. European Food Safety Authority (EFSA) Panel on Dietetic Products, Nutrition and Allergies (NDA). Scientific opinion on dietary reference values for protein. EFSA J 2012;10(2):2557. doi:10.2903/j.efsa.2012.2557.